Ensüümid
määratlus
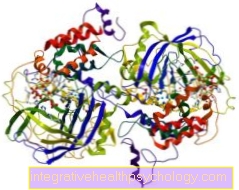
Ensüümid on keemilised ained, mida leidub kogu kehas. Nad panevad kehas liikuma keemilised reaktsioonid.
ajalugu
Sõna ensüüm tegi Wilhelm Friedrich Kühne 1878 ja tuleneb kreeka valmistatud sõnast ensüüm, mis tähendab pärmi või juuretist. See leidis siis tee rahvusvahelisse teadusesse. The puhta rakenduskeemia rahvusvaheline liit (IUPAC) ja rahvusvaheline biokeemia liit (IUBMB) töötasid koos välja ensüümide nomenklatuuri, mis määratleb selle suure ainerühma esindajad ühise rühmana. Nimetamine, mis liigitab ensüüme vastavalt nende ülesannetele, on oluline üksikute ensüümide ülesannete määramiseks.
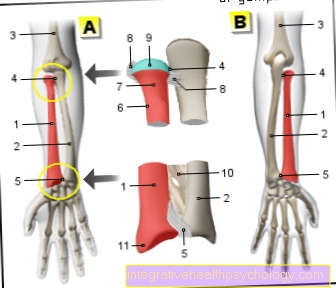
Ensüümide illustratsioon
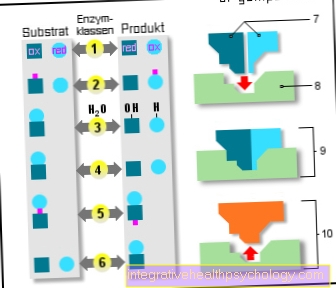
Ensüümid
6 ensüümi klassi:
- Oksidoreduktaasid
(Oksüdeerimine / redutseerimine) - Transferaasid
(Edasikandumine) - Hüdrolaasid
(Vee kasutamine) - Lüaasid
(Lõhustamine) - Isomeraasid
(sama empiiriline valem) - Ligaasid
(Liitmisreaktsioonid) - Aluspinnad
- Aktiivne keskus
- Ensüüm / substraat
keeruline - Ensüüm / toode
keeruline
Ülevaade kõigistDr-Gumperti pildid leiate aadressilt: meditsiinilised illustratsioonid
Nimetamine
The Nimetamine ensüüm on sisse lülitatud kolm põhiprintsiipi põhineb. –Aasiga lõppevad ensüüminimed kirjeldavad süsteemis mitmeid ensüüme. Ensüümi nimi kirjeldab ise ensüümi käivitatud reaktsiooni (katalüüsitud). Ensüümi nimi on ka ensüümi klassifikatsioon. Lisaks koodisüsteem, mis EÜ numbrite süsteem, milles ensüümid on valmistatud numbrilise koodi all neli numbrit võib leida. Esimene number tähistab ensüümide klassi. Kõigi tuvastatud ensüümide loendid tagavad, et määratud ensüümi kood on kiiremini leitav. Ehkki koodid põhinevad ensüümi katalüüsitava reaktsiooni omadustel, osutuvad numbrilised koodid tegelikkuses raskeks. Sagedamini kasutatakse ülaltoodud reeglitel põhinevaid süstemaatilisi nimesid. Nomenklatuuriga tekivad probleemid näiteks ensüümidega, mis katalüüsivad mitut reaktsiooni. Seetõttu on nende jaoks mõnikord mitu nime. Mõnel ensüümil on triviaalsed nimed, mis ei tähenda, et mainitud aine oleks ensüüm. Kuna nimesid on traditsiooniliselt laialdaselt kasutatud, on mõned neist säilinud.
Klassifikatsioon ensüümi funktsiooni järgi
IUPAC ja IUBMB andmetel jagatakse ensüümid vastavalt nende käivitatud reaktsioonile kuueks ensüümiklassiks:
- Oksidoreduktaasid
Oksidoreduktaasid panevad redoksreaktsioonid liikuma. Selles keemilises reaktsioonis kanduvad elektronid ühelt reaktsioonipartnerilt teisele. Üks aine vabastab elektrone (oksüdeerumine) ja teine aine aktsepteerib elektrone (redutseerimine).
Katalüüsitud reaktsiooni valem on A + B + A + B.
Aine vabastab elektroni (?) Ja oksüdeerub, samal ajal kui aine B neelab selle elektroni ja taandub. Seetõttu nimetatakse redoksreaktsioone ka redutseerimis-oksüdatsioonireaktsioonideks.
Paljud metaboolsed reaktsioonid on redoksreaktsioonid. Oksügenaasid viivad oma substraadile ühe või mitu hapniku aatomit. - Transferaasid
Transferaasid viivad funktsionaalse rühma ühest substraadist teise. Funktsionaalsed rühmad on orgaaniliste ühendite aatomirühmad, mis määravad olulisel määral aine omadused ja reaktsioonikäitumise. Keemilised ühendid, millel on samad funktsionaalsed rühmad, on sarnaste omaduste tõttu rühmitatud aineklassidesse. Funktsionaalsed rühmad jagunevad vastavalt sellele, kas need on heteroaatomid või mitte. Heteroaatomid on kõik orgaaniliste ühendite aatomid, mis ei ole süsinik ega vesinik.
Näiteks: -OH -> hüdroksüülrühm (alkoholid) - Hüdrolaasid
Hüdrolaasid lõhestavad sidemeid pöörduvates reaktsioonides, kasutades vett. Estrid, estrid, peptiidid, glükosiidid, happeanhüdriidid või C-C sidemed. Tasakaalureaktsioon on: A-B + H2O? A-H + B-OH.
Hüdrolaaside rühma kuuluv ensüüm on näiteks alfa-galaktosidaas. - Lüaasid
Lüaasid, mida nimetatakse ka süntaasideks, katalüüsivad keerukate toodete lõhustamist lihtsatest substraatidest ATP-d lahutamata. Reaktsiooniskeem on A-B → A + B.
ATP on adenosiinitrifosfaat ja nukleotiid, mis koosneb nukleosiidi adenosiini trifosfaadist (ja sellisena nukleiinhappe RNA energiarikkast ehitusmaterjalist). Kuid ATP on peamiselt igas rakus kohe kättesaadava energia universaalne vorm ja samal ajal oluline energiavarustuse protsesside regulaator. Vajadusel sünteesitakse ATP teistest energiavarudest (kreatiinfosfaat, glükogeen, rasvhapped). ATP molekul koosneb adeniinijäägist, suhkruriboosist ja kolmest fosfaadist (β kuni)) estris (an) või anhüdriidsidemetes (And ja?). - Isomeraasid
Isomeraasid kiirendavad isomeeride keemilist muundumist. Isomeeria on kahe või enama täpselt samade aatomite (sama empiirilise valemiga) ja molekulmassiga keemilise ühendi esinemine, mis aga erinevad aatomite ühendamise või ruumilise paigutuse poolest. Vastavaid ühendeid nimetatakse isomeerideks.
Need isomeerid erinevad keemiliste ja / või füüsikaliste omaduste ning sageli ka biokeemiliste omaduste poolest. Isomeeria esineb peamiselt orgaaniliste ühendite, aga ka (anorgaaniliste) koordineerivate ühenditega. Isomeeria on jagatud erinevateks aladeks. - Ligaasid
Ligaasid katalüüsivad ainete moodustumist, mis on keemiliselt keerukamad kui kasutatavad substraadid, kuid erinevalt lüaasidest on ensümaatiliselt efektiivsed ainult ATP lõhustamisel. Nende ainete moodustumine nõuab seetõttu energiat, mis saadakse ATP lõhustamisel.
Mõned ensüümid on võimelised katalüüsima mitut, mõnikord väga erinevat reaktsiooni. Sellisel juhul määratakse need mitmesse ensüümide klassi.
Samuti võite olla huvitatud nendest artiklitest:
- Alfa-glükosidaas
- Lipaas
- Trüpsiin
Klassifikatsioon ensüümi struktuuri järgi
Peaaegu kõik ensüümid on valgud ja neid saab klassifitseerida valguahela pikkuse põhjal:
- Monomeerid
Ensüümid, mis koosnevad ainult ühest valguahelast - Oligomeerid
Ensüümid, mis koosnevad mitmest valguahelast (monomeerid) - Mitme ensüümi ahelad
Mitmed liitunud ensüümid, mis teevad koostööd ja reguleerivad üksteist. Need ensüümahelad katalüüsivad järjestikuseid raku ainevahetuse etappe.
Lisaks on olemas üksikud valguahelad, mis sisaldavad mitut ensüümi aktiivsust; neid nimetatakse multifunktsionaalseteks ensüümideks.
Klassifikatsioon kofaktorite järgi
Teine klassifikatsioon on klassifikatsioon vastavalt kofaktorite kaalutlustele. Kofaktorid, koensüümid ja kaassubstraadid on mitmesuguste ainete klassifikatsioonide nimed, mis mõjutavad ensüümidega interaktsiooni kaudu biokeemilisi reaktsioone.
Arvesse võetakse orgaanilisi molekule ja ioone (enamasti metalliioone).
Puhta valgu ensüümid koosnevad eranditult valkudest ja aktiivne keskus moodustub ainult aminohapete jääkidest ja peptiidi selgroost. Aminohapped on orgaaniliste ühendite klass, millel on vähemalt üks karboksürühm (-COOH) ja üks aminorühm (-NH2).
Holoensüümid koosnevad valgu komponendist, apoensüümist ja kofaktorist, madala molekulmassiga molekulist (mitte valgust). Mõlemad koos on ensüümi toimimiseks olulised.
Koensüümid
Orgaanilisi molekule kui kofaktoreid nimetatakse koensüümideks. Kui nad on kovalentselt seotud apoensüümiga, nimetatakse neid proteesirühmadeks või kaassubstraatideks. Proteesirühm viitab mittevalgukomponentidele, mis on kindlalt (enamasti kovalentselt) seotud katalüütilise toimega valguga.
Kosubstraadid on mitmesuguste ainete klassifikatsioonide nimed, mis mõjutavad biokeemilisi reaktsioone ensüümidega toimimise kaudu. Biokatalüsaatoritena kiirendavad molekulid organismides toimuvaid reaktsioone, ensüümid biokeemilisi reaktsioone. Need vähendavad aktiveerimisenergiat, mis tuleb ületada, et aine saaks muunduda.











.jpg)